
CONCEITOS BÁSICOS SOBRE BATERIAS RECARREGÁVEIS
O que é uma bateria
Uma bateria é um dispositivo que converte a energia química contida em seus materiais ativos, diretamente em energia elétrica, por meio de uma reação eletroquímica de oxidação e redução.
Essa reação química envolve a transferência de elétrons dos materiais que se oxidam para os materiais que se reduzem através de um circuito elétrico.
No caso de um sistema recarregável, a bateria é recarregada por uma inversão desse processo.
Embora o termo "bateria" seja frequentemente utilizado, a unidade eletroquímica básica é a "célula". Uma bateria consiste em uma ou mais dessas células, conectadas em série ou em paralelo, ou ambos, dependendo da voltagem e capacidade de saída desejada.
A célula consiste em três componentes principais: anodo, catodo e eletrólito.
O anodo ou eletrodo negativo fornece os elétrons para o circuito externo e é oxidado durante a reação eletroquímica.
O catodo ou eletrodo positivo (eletrodo oxidante), aceita elétrons do circuito externo e é reduzido durante a reação eletroquímica.
O eletrólito (condutor iônico) fornece o meio para transferência de carga, como íons, dentro da célula entre o anodo e o catodo. O eletrólito é tipicamente um líquido, tal como água ou outros solventes com sais dissolvidos, ácidos ou alcalinos, para permitir a condutividade iônica.
Algumas baterias utilizam eletrólitos sólidos, que são condutores na temperatura de funcionamento da célula. Além desses três elementos principais, as baterias possuem separadores, recipientes, terminais e em alguns casos elementos de proteção tais como fusíveis e placas eletrônicas de proteção.
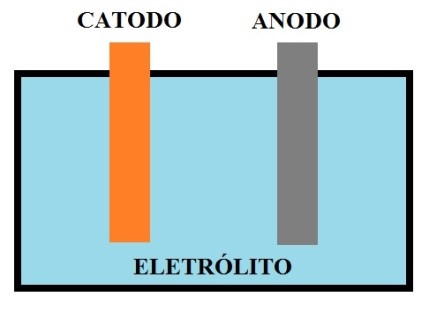
Figura 1 - Componentes básicos de uma célula
O funcionamento de uma célula durante a descarga é mostrado esquematicamente na figura 2.
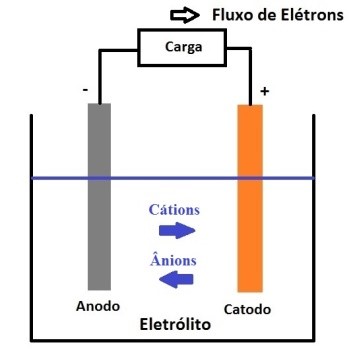
Figura 2 – Esquema eletroquímico na descarga
Quando a célula está conectada a uma carga externa, os elétrons fluem do anodo, que é oxidado, através da carga externa para o catodo, onde os elétrons são aceitos e o catodo é reduzido. O circuito elétrico é completado no eletrólito pelo fluxo de aníons (íons negativos) e cátions (íons positivos) para o anodo e o catodo, respectivamente.
Durante a recarga de uma célula recarregável, o fluxo de corrente é invertido e a oxidação ocorre no eletrodo positivo e a redução no eletrodo negativo, conforme ilustrado na figura 3. Como o anodo é, por definição, o eletrodo no qual ocorre a oxidação e o catodo, onde a redução ocorre, o eletrodo positivo é agora o anodo e o negativo é o catodo.
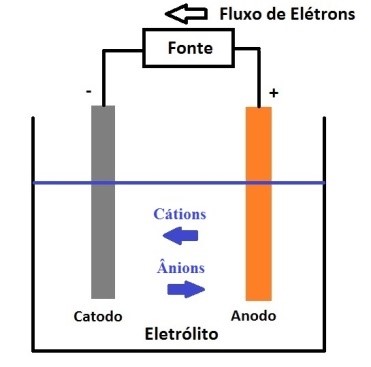
Figura 3 – Esquema eletroquímico na carga
Em algumas publicações, considera-se que o termo "bateria" refere-se a duas ou mais células. Popularmente considera-se "bateria" e não a "célula" como o produto que é vendido ou fornecido ao usuário, podendo conter uma ou mais células. A própria célula pode ser construída em muitas formas e configurações: cilíndrica, botão, plana e prismática. As células são seladas de maneira a evitar vazamento. Algumas células possuem dispositivos de ventilação ou outros meios para permitir que os gases acumulados escapem.
As baterias possuem alguns parâmetros básicos:
- Corrente Elétrica
- Tensão Elétrica ou Voltagem
- Capacidade
O que é corrente elétrica
Corrente elétrica, é um movimento ordenado de cargas elétricas dentro de um fio de metal, normalmente feito de cobre.
Fazendo uma analogia com um sistema hidráulico, a corrente elétrica é semelhante a uma corrente de água dentro de uma mangueira.
A corrente elétrica é medida em Ampère – abreviada por A. Um miliampère é igual a um Ampère dividido por 1000 (abreviado por mA).
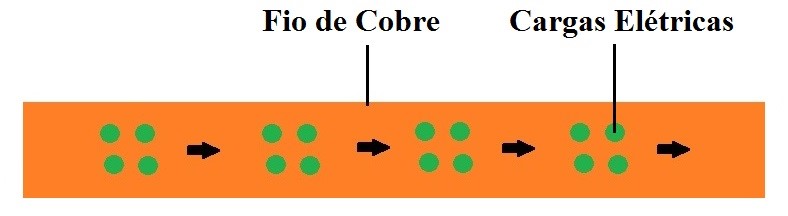
Figura 4 – Corrente elétrica
O que é tensão elétrica
Uma corrente para se estabelecer em um fio, precisa de uma força externa, ou seja, de algum tipo de ação externa que “empurre” as cargas elétricas e as coloque em movimento.
Fazendo uma comparação com um sistema de água, para que haja circulação de água, é necessária uma pressão. Essa pressão vem da caixa de água. É o peso da água que faz a água circular.
Essa pressão externa ou força externa é denominada tensão elétrica ou voltagem. O equipamento que gera essa força ou pressão externa chama-se gerador.
Uma bateria nada mais é do que um gerador elétrico. A bateria gera tensão elétrica. A tensão elétrica é medida em Volts – abreviada por V.
Quando uma carga (receptor) é ligada na bateria, a tensão da bateria provoca uma corrente. Essa carga pode ser uma lâmpada, um telefone sem fio, um celular. A corrente que vai circular depende da tensão e da carga.
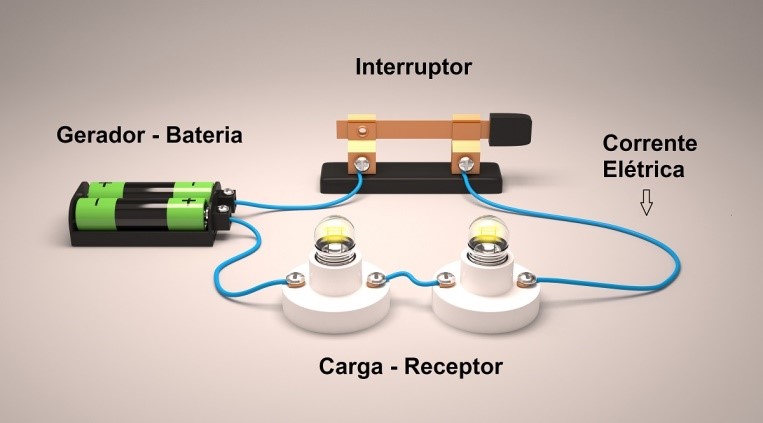
Figura 5 - Circuito elétrico básico
As tensões usuais para os diversos tipos de baterias recarregáveis são:
- Baterias de NiCd – 1,2V
- Baterias de NiMh – 1,2V
- Baterias de chumbo-ácido – 6V ou 12V
- Baterias de Li-Ion – 3,2V ou 3,6V ou 3,7V
O que é capacidade
A capacidade de uma bateria é a corrente que se pode tirar de uma bateria num dado período de tempo ou em outras palavras, a energia que se pode tirar de uma bateria.
Mede-se em ampère-hora (Ah) ou miliampère-hora (abreviada mAh).
Por exemplo, uma bateria de 1.300mAh pode alimentar uma carga com 65mA durante 20 horas (65mA x 20 horas = 1.300mAh).
Da mesma forma, uma bateria de 1.300mAh pode alimentar uma carga com 13mA durante 100 horas (13mA x 100 horas = 1.300mAh).
Quando fazemos referência neste livro à capacidade e à corrente das baterias, usamos a letra C.
Uma bateria sendo carregada com uma corrente de 1C significa que está sendo carregada com a corrente nominal. Uma bateria sendo carregada com uma corrente de 0,5C significa que está sendo carregada com metade corrente nominal.
Uma bateria sendo descarregada com uma corrente de 1C significa que está sendo descarregada com a corrente nominal.
Uma bateria sendo descarregada com uma corrente de 0,5C significa que está sendo descarregada com metade corrente nominal.

Indica uma característica das baterias NiCd mais antigas. Quando não eram descarregadas completamente até o limite inferior de tensão, nas descargas subsequentes perdiam parte de sua capacidade. É como se a bateria ficasse viciada em fornecer menos energia.
Melhorias na tecnologia da bateria têm praticamente eliminado esse fenômeno. Testes realizados em laboratórios mostram que o efeito memória nas baterias de NiCd mais modernas é tão pequeno que só pode ser detectado apenas com instrumentos sensíveis. Após a mesma bateria ser descarregada em diferentes intervalos de tempo, o efeito memória não foi mais observado.
O problema com a bateria à base de níquel não é o efeito memória, mas sim os efeitos da formação cristalina. Existem outros fatores envolvidos que causam degeneração de uma bateria. Por clareza e simplicidade, usamos a palavra “memória” para indicar a perda de capacidade em baterias à base de níquel que são reversíveis.
O cádmio de uma bateria NiCd está presente em cristais finos. Em uma boa bateria, esses cristais permanecem finos, obtendo uma área máxima de superfície. Quando o efeito memória ocorre, os cristais crescem e reduzem drasticamente a área da superfície. O resultado é uma depressão da tensão, que conduz a uma perda da capacidade.
Em estágios avançados, os cantos afiados dos cristais podem crescer através do separador, causando elevada autodescarga ou um curto-circuito.
Outra forma de memória que ocorre em algumas baterias de NiCd é a formação de um composto intermetálico de níquel e cádmio, criando resistência extra na bateria.
Recondicionamento por descarga profunda ajuda a romper esse composto e reverte a perda da capacidade. Os materiais ativos que não são carregados ou descarregados têm suas características físicas alteradas causando um aumento de resistência. Ciclos completos de carga/descarga irão restaurar os materiais ativos para seus estados originais.
Quando a bateria de NiMh foi introduzida havia muita publicidade sobre ser livre de efeito memória. Hoje, sabe-se que essa química também sofre de memória, mas não tanto quanto a de NiCd. A placa positiva de níquel, um metal que é compartilhado por ambas as químicas, é responsável pela formação cristalina.
Além da atividade de formação de cristais na placa positiva, a bateria de NiCd também desenvolve cristais na placa negativa de cádmio. Porque ambas as placas são afetadas pela formação cristalina, a bateria de NiCd requer ciclos de descarga mais frequentes que a bateria de NiMh. Isto é uma explicação do porque a bateria de NiCd é mais propensa à memória que a de NiMh.
Baterias de lítio e à base de chumbo não são afetadas pelo efeito memória, mas essas químicas têm suas próprias peculiaridades. Camadas inibidoras de corrente afetam ambas as químicas – oxidação da placa na bateria de lítio e a sulfatação e corrosão nos sistemas de chumbo-ácido.
Esses efeitos degenerativos não são corrigíveis no sistema à base de lítio e apenas parcialmente reversíveis no de chumbo-ácido.
