COMO FUNCIONAM AS BATERIAS
Como funcionam as baterias
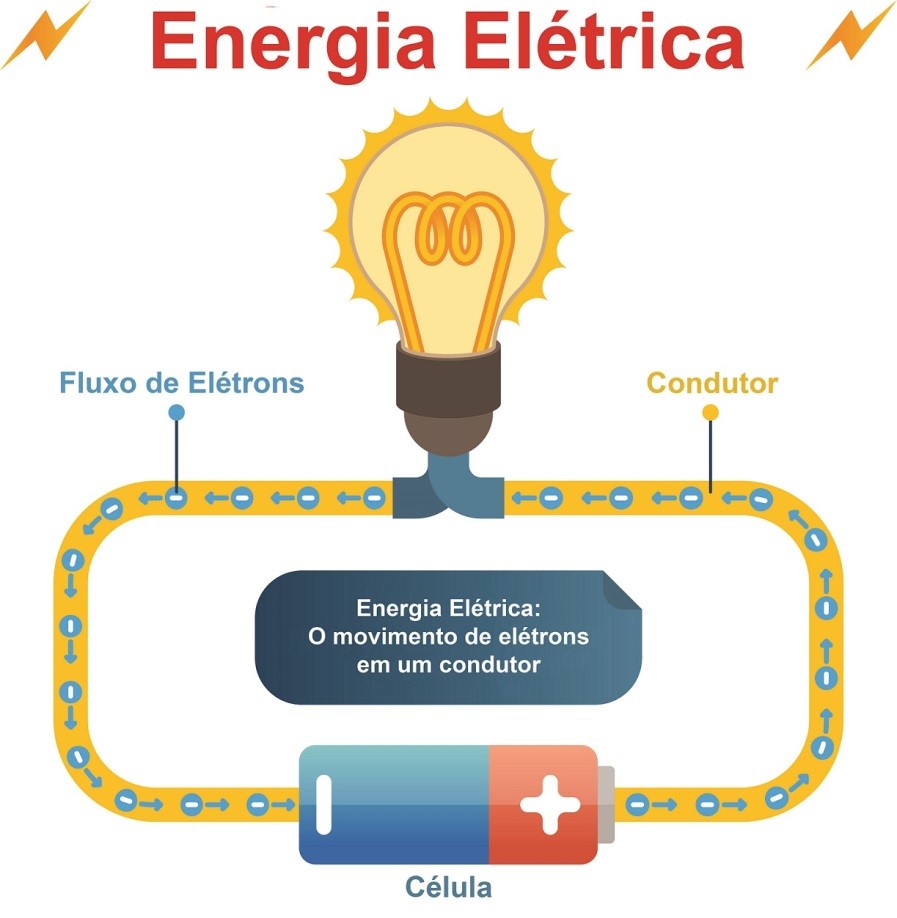
Circuito elétrico elementar com bateria e lâmpada
Uma bateria é um dispositivo que converte a energia química contida em seus materiais ativos, diretamente em energia elétrica, por meio de uma reação eletroquímica de oxidação e redução.
Essa reação química envolve a transferência de elétrons dos materiais que se oxidam (perdem elétrons) para os materiais que se reduzem (ganham elétrons) através de um circuito elétrico.
No caso de um sistema recarregável, a bateria é recarregada por uma inversão desse processo.
Embora o termo "bateria" seja frequentemente utilizado, a unidade eletroquímica básica é a "célula".
Uma bateria consiste em uma ou mais dessas células, conectadas em série ou em paralelo, ou ambos, dependendo da voltagem e capacidade de saída desejada.
Em algumas publicações, considera-se que o termo "bateria" refere-se a duas ou mais células.
Popularmente considera-se "bateria" e não a "célula" como o produto que é vendido ou fornecido ao usuário, podendo conter uma ou mais células.
A própria célula pode ser construída em muitas formas e configurações: cilíndrica, botão, plana e prismática.
As células são seladas de maneira a evitar vazamento. Algumas células possuem dispositivos de ventilação ou outros meios para permitir que os gases acumulados escapem.
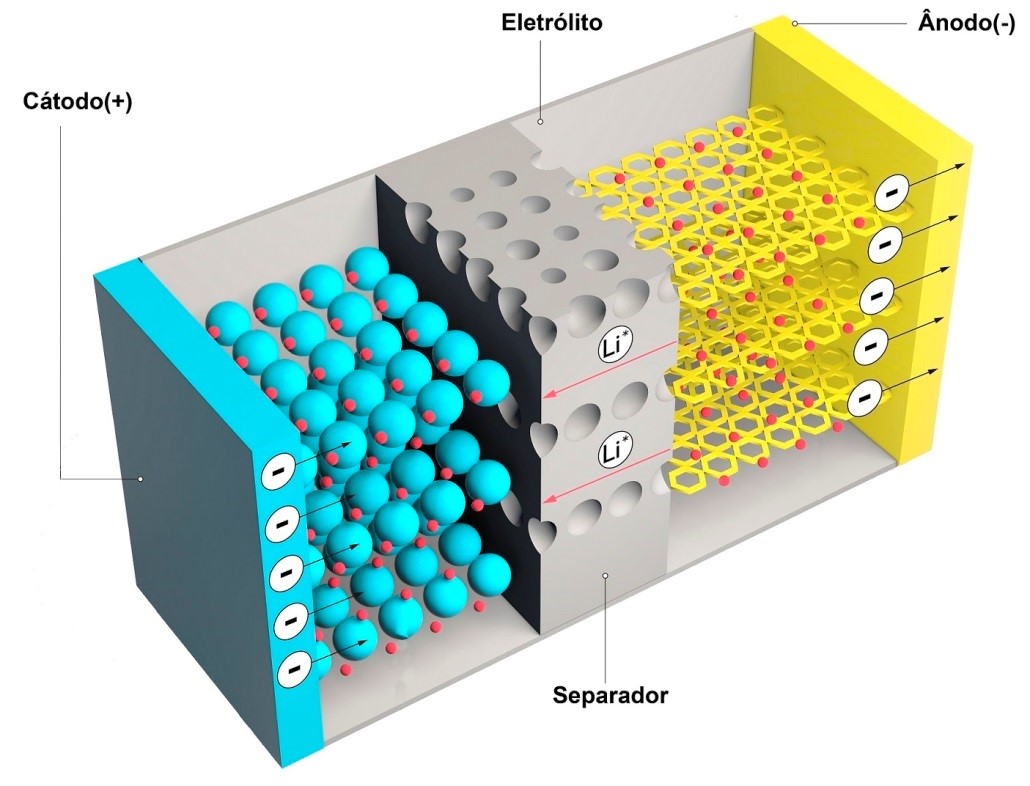
A célula consiste em quatro componentes principais:
- Ânodo
- Cátodo
- Eletrólito
- Separador
Componentes básicos de uma célula de lítio íon
O ânodo ou eletrodo negativo fornece os elétrons para o circuito externo e é oxidado durante a reação eletroquímica.
O cátodo ou eletrodo positivo (eletrodo oxidante), aceita elétrons do circuito externo e é reduzido durante a reação eletroquímica.
O eletrólito (condutor iônico) fornece o meio para transferência de carga, como íons, dentro da célula entre o ânodo e o cátodo.
O eletrólito é tipicamente um líquido, tal como água ou outros solventes com sais dissolvidos, ácidos ou alcalinos, para permitir a condutividade iônica.
Algumas baterias utilizam eletrólitos sólidos, que são condutores na temperatura de funcionamento da célula.
Além desses três elementos principais, as baterias possuem separadores, recipientes, terminais e em alguns casos elementos de proteção tais como fusíveis e placas eletrônicas de proteção.
O funcionamento de uma célula durante a descarga é mostrado esquematicamente na figura a seguir.
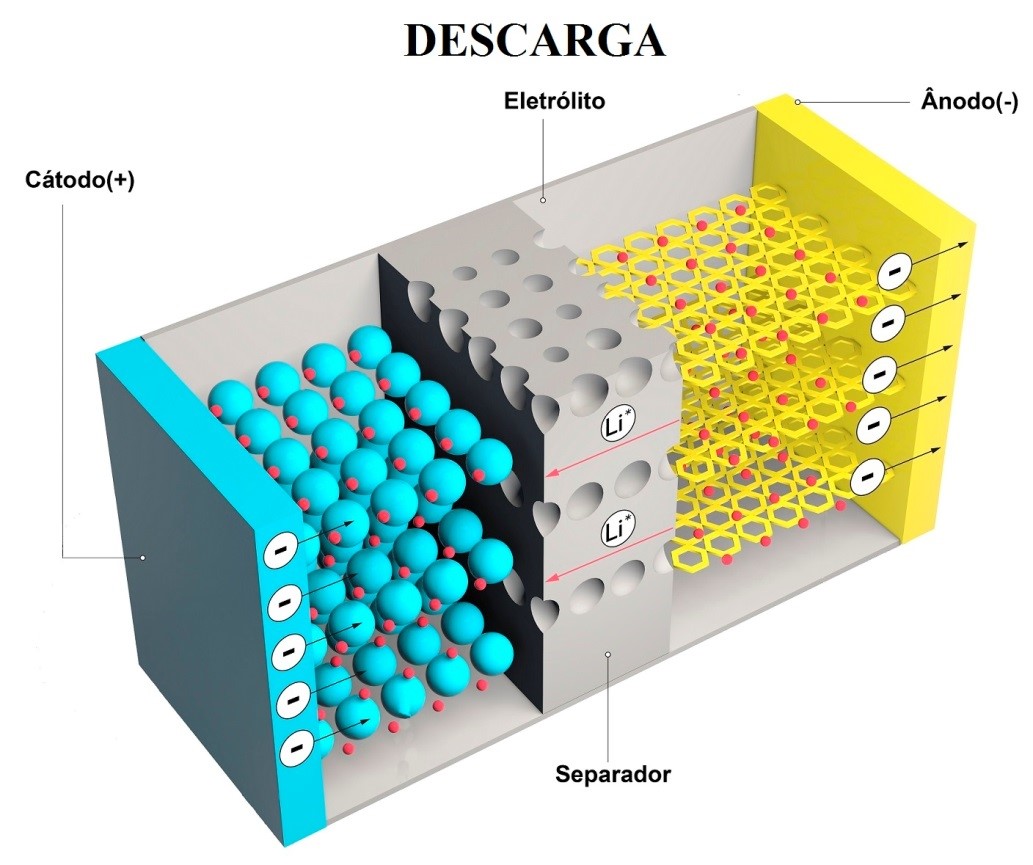
Esquema eletroquímico na descarga
Quando a célula está conectada a uma carga externa, os elétrons fluem do ânodo, que é oxidado, através da carga externa para o cátodo, onde os elétrons são aceitos e o cátodo é reduzido.
O circuito elétrico é completado no eletrólito pelo fluxo de ânions (íons negativos) para o ânodo e cátions (íons positivos) para o cátodo.
Durante a recarga de uma célula recarregável, o fluxo de corrente é invertido e a oxidação ocorre no eletrodo positivo e a redução no eletrodo negativo, conforme ilustrado na figura abaixo.
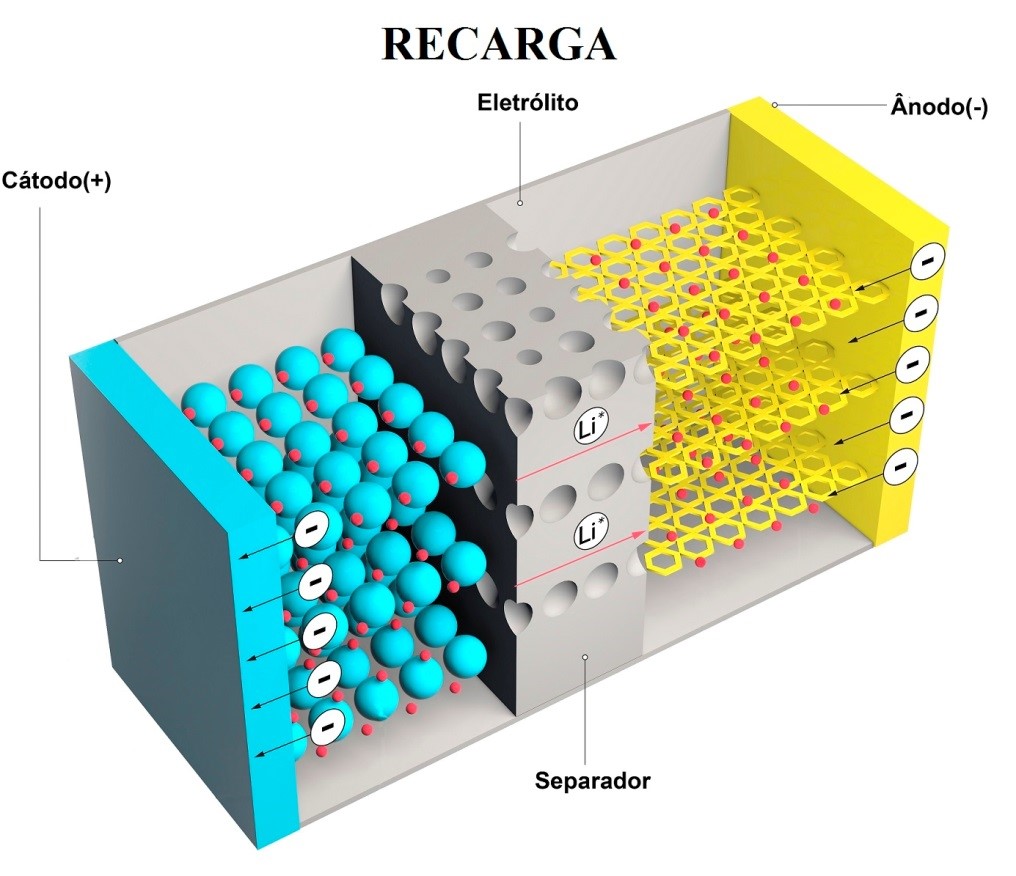
Esquema eletroquímico na recarga
Os melhores materiais de ânodo e cátodo são aqueles que são mais leves, fornecem uma tensão elevada e permitem a construção de baterias de alta capacidade.
Na prática, a escolha dos materiais das baterias, envolve a reatividade desses materiais com outros componentes da célula, dificuldade de manuseio, alto custo e outras características.
Em um sistema prático, o ânodo é selecionado com as seguintes propriedades: eficiência como agente redutor, alta saída de energia (Ah/g), boa condutividade, estabilidade, facilidade de fabricação e baixo custo.
Como material de ânodo é usado principalmente metais. Em pilhas comuns usa-se o zinco. O lítio, que é um metal mais leve, tem se tornado uma ótima opção, desde que utilizado com eletrólitos adequados e com projetos de células que foram desenvolvidos para controlar sua atividade.
O cátodo deve ser um agente oxidante eficiente, ser estável quando em contato com o eletrólito e ter uma tensão de trabalho útil.
O oxigênio pode ser usado diretamente do ar ambiente que está sendo extraído na pilha, como na bateria do zinco/ar.
No entanto, a maioria dos materiais catódicos comuns são óxidos metálicos. Outros materiais catódicos são usados para sistemas de bateria especiais.
O eletrólito deve ter boa condutividade iônica, mas não pode ser eletricamente condutor, pois isso causaria curto-circuito interno na bateria.
Outras características importantes são a não reatividade com os materiais do eletrodo, pouca mudança nas propriedades com mudança na temperatura, segurança na manipulação e baixo custo.
Fisicamente os eletrodos de ânodo e cátodo são eletricamente isolados na célula para evitar curtos-circuitos internos, mas são cercados pelo eletrólito.
Em projetos práticos de baterias, um material separador é usado para separar mecanicamente os elétrodos do ânodo e do cátodo. O separador, no entanto, é permeável ao eletrólito, a fim de manter a condutividade iônica desejada. A célula em si pode ser construída em muitas formas e configurações - cilíndrica, botão, plana e prismática - e os componentes celulares são projetados para acomodar a forma específica da célula. As células são seladas de várias maneiras para evitar vazamentos.
Algumas células são fornecidas com dispositivos de ventilação ou outros meios para permitir que gases acumulados escapem. Caixas ou recipientes adequados, meios para conexão e terminais são adicionados para concluir a fabricação da célula.
As células eletroquímicas e baterias são identificadas como primárias ou secundárias, dependendo de sua capacidade de serem recarregadas eletricamente.
- PRIMÁRIAS – NÃO RECARREGÁVEIS
- SECUNDÁRIAS - RECARREGÁVEIS

Baterias primárias - não recarregáveis
Células ou baterias primárias não podem ser recarregadas e, portanto, são descarregadas uma única vez e então descartadas. A bateria primária é uma fonte conveniente, geralmente barata e leve de energia para dispositivos eletrônicos e elétricos portáteis, iluminação, equipamento fotográfico, brinquedos, backup de memória e uma série de outras aplicações.
As vantagens gerais das baterias primárias são uma boa vida útil, alta densidade de energia com baixas ou moderadas taxas de descarga e facilidade de uso.
Embora grandes baterias primárias de alta capacidade sejam usadas em aplicações militares, sinalização ou outras aplicações de maior porte, a grande maioria das baterias primárias são as baterias do tipo botão, cilíndricas e as prismáticas de 9V.
Células ou baterias secundárias ou recarregáveis podem ser recarregadas eletricamente, após a descarga, retornando à sua condição original. A recarga é feita passando a corrente através delas na direção oposta à da corrente de descarga.

Baterias Secundárias - recarregáveis
São dispositivos de armazenamento de energia elétrica e são conhecidos também como acumuladores.
As baterias secundárias são usadas em sistemas de energia de emergência (nobreak), sistemas automotivos e aeronáuticos, veículos elétricos ou híbridos, em equipamentos eletrônicos portáteis, ferramentas elétricas, etc.
As baterias secundárias, por serem recarregáveis, costumam ser bem mais econômicas que as baterias primárias ou não recarregáveis. As baterias recarregáveis também costumam ser a melhor escolha em aplicações que exigem consumo de energia elevado, o qual não se consegue com a capacidade das baterias primárias.
As baterias secundárias são caracterizadas, além de sua capacidade de serem recarregadas, pela alta densidade de potência, alta taxa de descarga, curvas de descarga plana e bom desempenho em baixa temperatura.
Sua densidade de energia é geralmente mais baixa do que aquela das baterias primárias. Sua retenção de carga também é mais pobre do que a da maioria das baterias primárias, embora a capacidade da bateria secundária que é perdida possa ser restaurada a partir da recarga.