
A HISTÓRIA DAS BATERIAS
A Primeira Bateria
A eletricidade já era conhecida desde os tempos antigos, mas somente a partir de 1800 é que se começou a entender os mecanismos de como produzi-la e utilizá-la de maneira adequada.
A primeira bateria que se tem notícia foi encontrada perto de Bagdá durante a construção de uma ferrovia em 1936. Acredita-se que essa bateria foi construída há 2.000 anos. Trata-se de uma jarra de barro, que provavelmente era preenchida com uma solução de vinagre, onde se colocava uma haste de ferro dentro de um cilindro de cobre.
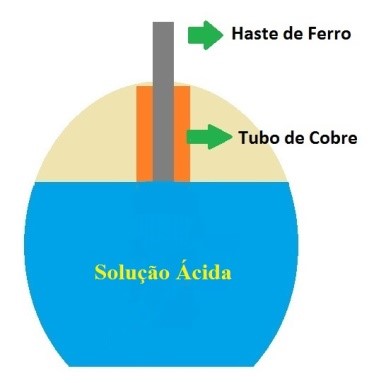
Figura 1 - Suposta bateria antiga
Não se tem certeza que essas jarras de barro fossem baterias elétricas. Se fossem baterias, quem as fabricou e para que serviram? Infelizmente, não há registro escrito sobre a função exata da jarra de barro, mas a melhor suposição é que era um tipo de bateria.
Os cientistas acreditam que essas baterias, se essa foi a sua função correta, foram usadas para galvanização, como por exemplo, colocar uma camada de um metal (ouro) na superfície de outro (prata), um método ainda praticado hoje.
Durante a década de 1780 um físico italiano Luigi Galvani realizou experimentos que envolveram pernas de rã. Ao introduzir diferentes metais no corpo da rã, como um gancho de bronze e um bisturi de ferro, Galvani notou que os músculos da rã se contraiam.
Uma primeira explicação para o fenômeno era que a contração muscular era devida à eletricidade produzida pelo animal. Posteriormente outro físico italiano Alessandro Volta, concluiu que não era a perna da rã que produzia eletricidade, mas sim a interação dos dois metais diferentes é que gerava eletricidade.
A pilha de Volta
O crédito pela invenção da bateria elétrica é dado ao cientista italiano Alessandro Volta, em 1800. Volta observou que quando duas sondas de metais diferentes são colocadas em certas soluções químicas, ocorre a produção de eletricidade. Em homenagem a Volta é que a unidade de medida de tensão elétrica chama-se volt.
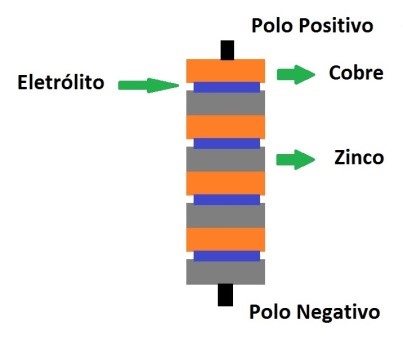
Figura 2 - Esquema da pilha de Volta
Volta colocou camadas de zinco e cobre juntas, separadas por um pano embebido em salmoura. Mas apesar de entregar correntes consistentes, a sua invenção não era capaz produzir eletricidade por muito tempo.
Uma das principais falhas em sua invenção foi o vazamento de salmoura entre as placas metálicas, causando curto-circuito.

Volta também descobriu que ligando várias baterias em série se obteria a soma das tensões de cada bateria. Descobriu também que metais diferentes, têm comportamentos diferentes numa bateria elétrica. Os metais determinam a tensão da bateria.
Em 1802, Willian Cruickshank projetou a primeira bateria para produção em massa. Ele cortou várias chapas quadradas de zinco e cobre de igual tamanho. Essas chapas foram colocadas dentro de uma caixa selada de madeira e foram soldadas entre si. Depois a caixa de madeira era preenchida com uma solução ácida.
A pilha de Daniell
Em 1836, John F. Daniell, um químico inglês, inventou uma bateria capaz de produzir eletricidade de forma mais estável que as anteriores. O funcionamento da pilha de Daniell é semelhante à pilha de Volta já que possui eletrodos feitos de cobre e zinco. Porém na pilha de Daniell os eletrodos estão em compartimentos separados e se utiliza uma ponte salina para fechamento do circuito elétrico. Os eletrodos de cobre e zinco são imersos numa solução de sulfato de cobre e sulfato de zinco, respectivamente. A pilha de Daniell foi uma das baterias antigas mais bem sucedidas, sendo usada para alimentar dispositivos de comunicação.
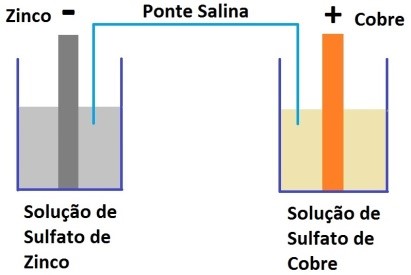
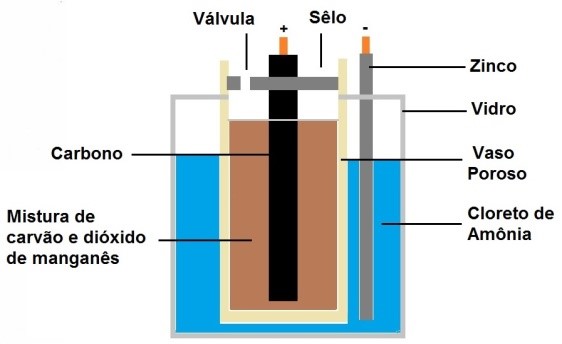
A pilha de Leclanché
Em 1865, o engenheiro francês Georges Leclanché inventou uma bateria que pode ser considerada a precursora das pilhas comuns que são usadas hoje em dia. A pilha de Leclanché é formada por um cilindro de zinco metálico que forma o anodo ou polo negativo e um cilindro de grafite que forma o catodo ou polo positivo. O cilindro de grafite é coberto por uma camada de dióxido de manganês e carvão em pó. Esta pilha tem característica ácida por causa do cloreto de amônia. A pilha de Leclanché não é recarregável, pois a reação química que ocorre em seu interior é irreversível. Com isso a pilha cessa seu funcionamento quando não há mais dióxido de manganês para ser consumido.
As baterias atuais
Em 1859, o físico francês Gaston Planté inventou a primeira bateria recarregável à base de chumbo e ácido, que se tornou o primeiro tipo de bateria recarregável a ser comercializado.
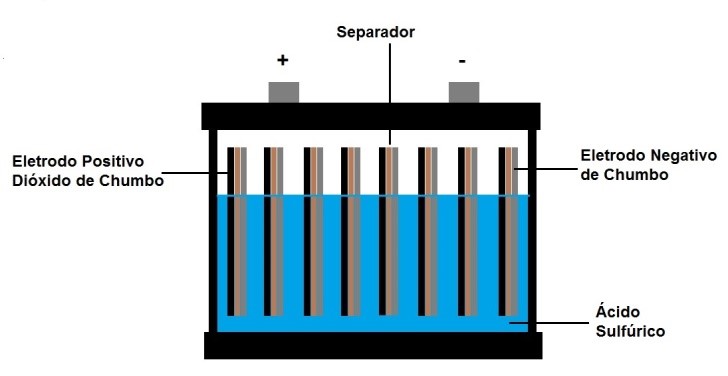
Figura 6 - Bateria de chumbo-ácido
A bateria de chumbo-ácido é constituída de dois eletrodos, um de chumbo e o outro de dióxido de chumbo, ambos mergulhados em uma solução de ácido sulfúrico. Esta célula é capaz de produzir 2 volts. Associando-se várias células em série conseguem-se tensões maiores, como por exemplo, 12V que é a tensão mais comum nas baterias de carros.
Para recarregar a bateria, conecta-se uma fonte de corrente contínua nos dois eletrodos o que resulta na inversão das reações químicas. Neste processo o ácido sulfúrico é recuperado.
Com o passar do tempo a bateria de chumbo ácido evoluiu e hoje temos as baterias de chumbo seladas - VRLA (valve-regulated lead acid – bateria de chumbo-ácido regulada por válvula) ou bateria de gel que é um tipo de bateria de chumbo-ácido livre de manutenção.
Por ser selada pode estar em ambientes fechados, pois não libera gases nocivos. É muito utilizada em nobreaks, sistemas de alarme, geração de energia eólica, luz de emergência, telecomunicações e brinquedos elétricos.
Em 1899, Waldmar Jungner, da Suécia, inventou a bateria recarregável de níquel-cádmio (NiCd) que usava níquel como eletrodo positivo (catodo) e cádmio como negativo (anodo). O alto custo do material em comparação com o chumbo limitou seu uso.
Dois anos depois, Thomas Edison substituiu o cádmio por ferro, inventando a bateria de níquel-ferro (NiFe). Problemas tais como baixa energia, mau desempenho em temperaturas baixas ou elevadas e autodescarga excessiva limitaram o sucesso dessa bateria.
Com o passar dos anos a bateria NiCd evoluiu, conseguindo-se correntes mais elevadas, maior longevidade bem como se conseguiu produzir células seladas e pequenas. Durante muitos anos, o NiCd foi a única bateria recarregável para aplicações portáteis, porém essa bateria causa danos ao meio ambiente quando não é descartada adequadamente.
Na década de 1990, os ambientalistas na Europa começaram a trabalhar para que o uso dessa bateria fosse bastante limitado. Hoje a comercialização dessas baterias é restrita em vários países por questões ambientais.
A alternativa é a bateria de níquel-hidreto metálico - NiMh, uma bateria mais ecológica e que tem características semelhantes à bateria de NiCd, porém com melhor desempenho em termos de energia específica.
A bateria de níquel-hidreto metálico causa muito menos dano ao meio ambiente do que as baterias de níquel-cádmio. As baterias de níquel-hidreto metálico são uma espécie de continuação das baterias de níquel-cádmio.
Essa tecnologia consiste na substituição do eletrodo à base de cádmio por um eletrodo negativo que absorve hidrogênio. Esta substituição aumenta a capacidade da bateria para um determinado peso e volume e elimina o cádmio que polui o meio ambiente. No restante, as baterias de níquel-hidreto metálico são bastante semelhantes ao produto de níquel-cádmio. Muitos parâmetros de aplicação são pouco alterados entre os dois tipos de bateria.
Atualmente, a maioria das pesquisas gira em torno das baterias de lítio, comercializadas pela primeira vez pela Sony em 1991. Além de alimentar telefones celulares, laptops, câmeras digitais, ferramentas elétricas e dispositivos médicos, o lítio também é usado para veículos elétricos e satélites. A bateria tem uma série de benefícios, tais como sua alta energia específica, carga simples, baixa manutenção e causa menores danos ao ambiente.
